BLOG
DE QUIMICA DEL CARBONO
ISOTOPOS DEL CARBONO
Los isótopos del carbono
son átomos que representan al mismo elemento con el mismo número atómico, pero
con diferente masa atómica. Todos tienen 6 electrones distribuidos en los
diferentes niveles.

ENLACES
COVALENTES

Los cuatro electrones en su capa externa posee números de
oxidación que van de 4+ a 4–, y forma enlaces predominantemente
covalentes. Las reacciones entre dos átomos no metales producen enlaces
covalentes. Este tipo de enlace se produce cuando existe
electronegatividad polar y se forma cuando la diferencia de electronegatividad
no es suficientemente grande como para que se efectúe la transferencia de
electrones.
Por ejemplo, del metano, que es la unión de cuatro hidrógenos
con un carbono, representa el enlace covalente.
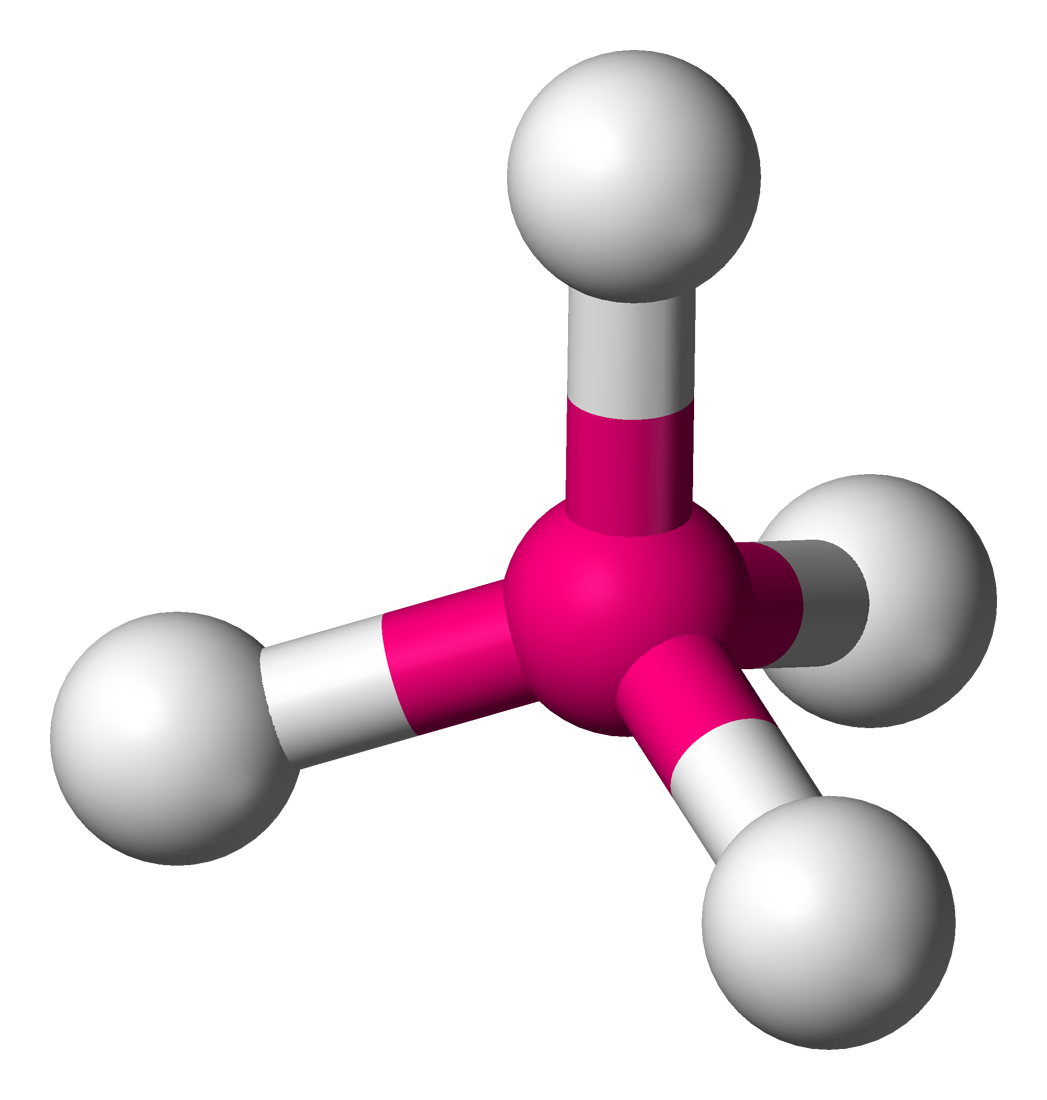
ESTRUCTURA
TETRAEDRICA
Generalmente, un átomo de carbono forma cuatro enlaces
covalentes. La disposición geométrica más común de estos enlaces es la
tetraédrica. En esta estructura, los cuatro enlaces covalentes no están en un
plano alrededor del átomo de carbono, sino que se dirigen hacia las esquinas de
un tetraedro regular, (un tetraedro s un sólido geométrico con cuatro lados.)
El ángulo entre estos enlaces tetraédricos es 109.5°.

QUIMICA ORGANICA
Química
orgánica: Se asoció a la química de los seres vivos y
sustancias relacionadas con ellos. Se pensaba que las sustancias orgánicas sólo
las podían sintetizar los seres vivos porque para preparar compuestos orgánicos
se necesitaba algo que sólo poseían los seres vivos la fuerza vital. Química
inorgánica: Se asoció a las sustancias inertes. Comprendía al resto de la
química distinta a la química relacionada con los seres vivos.


IMPORTANCIA DE LOS COMPUESTOS DEL CARBONO
Los compuestos de
carbono tienen una gran importancia por la capacidad que tienen de unirse entre
sí y con átomos no metálicos como: hidrógeno, oxígeno, nitrógeno, fósforo,
azufre y en menor proporción con: flúor, cloro, bromo, yodo y otros muchos más.
Los compuestos de carbono constituyen a la mayoría de los seres vivos por medio
de compuestos orgánicos.

HIDROCARBUROS
Los hidrocarburos son compuestos
orgánicos formados únicamente por átomos de carbono e hidrógeno. La estructura molecular consiste en
un armazón de átomos de carbono a los que se unen los átomos de hidrógeno. Los
hidrocarburos son los compuestos básicos de la Química
Orgánica. Las cadenas
de átomos de carbono pueden ser lineales o ramificadas y abiertas o cerradas.
Los que tienen en su molécula otros elementos químicos (heteroátomos),se denominan hidrocarburos sustituidos.
Los hidrocarburos se pueden clasificar en dos tipos, que son alifáticos y aromáticos. Los alifáticos, a su vez se pueden clasificar en alcanos, alquenos y alquinos según los tipos de enlace que unen entre sí los átomos de carbono. Las fórmulas generales de los alcanos, alquenos y alquinos son CnH2n+2, CnH2n y CnH2n-2, respectivamente.
ALCANOS:
El primer miembro de la
familia de los alcanos es el metano. Está formado por un
átomo de carbono, rodeados de 4 átomos de hidrógeno.

Donde cada línea representa un enlace covalente. El alcano
más sencillo es el metano con un solo átomo de carbono. Otros alcanos
conocidos son el etano, propano y el butano con dos, tres y cuatro átomos de carbono
respectivamente. A partir de cinco carbonos, los nombres se derivan de
numerales griegos: pentano, hexano, heptano...
Nomenclatura
La nomenclatura IUPAC (forma sistemática de denominar a los
compuestos) para los alcanos es el punto de partida para todo el sistema de
nomenclatura. Se basa en identificar a las cadenas hidrocarbonadas. Las cadenas
de hidrocarburos saturados lineales son nombradas sistemáticamente con un
prefijo numérico griego que denota el número de átomos de carbono, y el sufijo "-ano".
Los 4 primeros reciben los nombres de metano, etano, propano y butano.
Los alcanos se obtienen
mayoritariamente del petróleo,
ya sea directamente o mediante cracking o pirólisis,
esto es, rotura térmica de moléculas mayores. Son los productos base para
la obtención de otros compuestos orgánicos. Estos son algunos ejemplos de
alcanos:
| C | Nombre | Fórmula | Modelo |
|---|---|---|---|
| 1 | Metano | CH4 | |
| 2 | Etano | C2H6 | |
| 3 | Propano | C3H8 | |
| 4 | n-Butano | C4H10 | |
| 5 | n-Pentano | C5H12 | |
| 6 | n-Hexano | C6H14 | |
| 7 | n-Heptano | C7H16 | |
| 8 | n-Octano | C8H18 | |
| 9 | n-Nonano | C9H20 | |
| 10 | n-Decano | C10H22 | |
| 11 | n-Undecano | C11H24 | |
| 12 | n-Dodecano | C12H26 |
Propiedades físicas:
Los alcanos son parte de una serie llamada
homóloga. Ya que cada término se diferencia del que le continúa en un CH2.
Esto nos ayuda a entender sus propiedades físicas ya que sabiendo la de algunas
podemos extrapolar los resultados a las demás. Las principales características
físicas son:
Los cuatro primeros
miembros bajo condiciones normales o en su estado natural son gaseosos.
Entre el de 5 carbonos y
el de 15 tenemos líquidos y los restantes sólidos.
El punto de ebullición
asciende a medida que crece el número de carbonos.
Todos son de menor
densidad que el agua.
Son insolubles en el
agua pero solubles en solventes orgánicos.
Presentan muy poca
reactividad con la mayoría de los reactivos químicos. Por este motivo se los
llama también parafinas.
El ácido sulfúrico,
hidróxido de sodio, ácido nítrico y ciertos oxidantes los atacan solo a elevada
temperatura.
CH3 — CH3
—————-> CH3 — CH2 NO2 + H2O (a 430°C y
en presencia de HNO3)
Combustión:
CH3 —
CH3 + 7/2 O2 ——> 2
CO2 + 3 H2O + 372,8 Kcal
Compuestos de
Sustitución:
Las reacciones de
sustitución son aquellas en las que en un compuesto son reemplazados uno o más
átomos por otros de otro reactivo determinado.
Loa alcanos con los
halógenos reaccionan lentamente en la oscuridad, pero más velozmente con la
luz.
CH4
+ Cl2 —–>
CH3Cl
+ HCl
metano
(luz) cloruro de metilo
ALQUENOS:

Los alquenos se diferencian con los alcanos en que
presentan una doble ligadura a lo largo de la molécula. Esta condición los
coloca dentro de los llamados hidrocarburos insaturados junto con los alquinos.
Con respecto a su nomenclatura es como la de los alcanos salvo la terminación.
En lugar de ano como los alcanos es eno. Al tener una doble ligadura hay dos
átomos menos de hidrógeno como veremos en las siguientes estructuras. Por lo
tanto, la fórmula general es CnH2n.
Explicaremos a
continuación como se forma la doble ligadura entre carbonos.
Anteriormente explicamos
la hibridación SP3. Esta vez se produce la hibridación Sp2.
El orbital 2s se combina con 2 orbitales p, formando en total 3 orbitales
híbridos llamados Sp2. El restante orbital p queda sin combinar. Los
3 orbitales Sp2 se
ubican en el mismo plano con un ángulo de 120° de distancia entre ellos.
El orbital p que no
participo en la hibridación ocupa un lugar perpendicular al plano que sostiene
a los tres orbitales Sp2.
El enlace doble se forma
de la siguiente manera:
Uno de los orbitales sp2 de un C se enlaza con otro orbital sp2 del otro C formando un enlace llamado
sigma. El otro enlace está constituido por la superposición de los enlaces p
que no participaron en la hibridación. Esta unión se denomina Pi (∏).
Así tenemos por ejemplo
Eteno, Propeno, Buteno, etc.
Al nombrar Alquenos y
Alquinos a la doble o triple ligadura se le adjudica un número que corresponde
a la ubicación de dicha ligadura.
Eteno:
CH2
= CH2
Propeno:
CH2
= CH2 –CH3
Buteno
– 1
CH2
= CH — CH2 — CH3
Buteno
– 2
CH3
– CH = CH — CH3
Pentino
– 2
CH3 — C ≡ C
— CH2 —-CH3
Propiedades
Físicas:
Son similares a los
alcanos. Los tres primeros miembros son gases, del carbono 4 al carbono 18
líquidos y los demás son sólidos.
Son solubles en
solventes orgánicos como el alcohol y el éter. Son levemente más densos que los
alcanos correspondientes de igual número de carbonos. Los puntos de fusión y
ebullición son más bajos que los alcanos correspondientes. Es interesante
mencionar que la distancia entre los átomos de carbonos vecinos en la doble
ligadura es más pequeña que entre carbonos vecinos en alcanos. Aquí es de unos
1.34 amstrong y en los alcanos es de 1.50 amstrong.
Los alquenos son mucho más reactivos que los
Alcanos. Esto se debe a la presencia de la doble ligadura que permite las reacciones
de adición. Las reacciones de adición son las que se presentan cuando se rompe
la doble ligadura, este evento permite que se adicionen átomos de otras
sustancias.
Estos presentan una
triple ligadura entre dos carbonos vecinos. Con respecto a la nomenclatura la
terminación ano o eno se cambia por ino. Aquí hay dos hidrógenos menos que en
los alquenos. Su fórmula general es CnH2n-2. La distancia
entre carbonos vecinos con triple ligadura es de unos 1.20 amstrong.
Para la formación de un
enlace triple, debemos considerar el otro tipo de hibridación que sufre el
átomo de C. La hibridación “sp”.
En esta hibridación, el
orbital 2s se hibridiza con un orbital p para formar dos nuevos orbitales
híbridos llamados “sp”. Por otra parte quedaran 2 orbitales p sin cambios por
cada átomo de C.
El triple enlace que se
genera en los alquinos está conformado por dos tipos de uniones. Por un lado dos
orbitales sp solapados constituyendo una unión sigma. Y las otras dos se forman
por la superposición de los dos orbitales p de cada C.
Los dos primeros son
gaseosos, del tercero al decimocuarto son líquidos y son sólidos desde el 15 en
adelante.
Su punto de ebullición
también aumenta con la cantidad de carbonos.
Los alquinos son solubles en solventes orgánicos
como el éter y alcohol. Son insolubles en agua, salvo el etino que presenta un
poco de solubilidad.
Propiedades
Químicas:
Combustión:
2 HC ≡ CH +
5 O2 ——> 4 CO2 + 2 H2O + 332,9 Kcal
Adición de Halógenos:
HC ≡ CH —-
CH3 + CL2 —> HCCl
= CCl — CH3
Propino
,2 – dicloro propeno
Adición de Hidrógeno: Se
usan catalizadores metálicos como el Platino para favorecer la reacción.
HC
≡ C —- CH3 + H2 ——> H2C = CH
— CH3
Propino
Propeno
Se puede continuar con
la hidrogenación hasta convertirlo en alcano si se lo desea.
Adición de Hidrácidos:
HC ≡ CH —-
CH3 + HBr —-> H2C = C Br —-
CH3
Propino –
1
Bromo – 2 – Propeno
Como se observa se sigue
la regla de Markownicov. Ya que el halógeno se une al carbono con menos
hidrógenos.










No hay comentarios.:
Publicar un comentario